Problemas de termodinámica
Disponemos de una central termica oceanica con potencia de 100 MW. La zona en la que esta instalada la central dispone de agua caliente en superficie de 20ºc de temperatura y de agua fría a 4ºc en el fondo marino. Teniendo en cuenta que el rendimiento de la central es del 2% . Calcular los 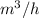 de agua caliente que debe consumir la central para proporcionar la potencia útil adecuada.
de agua caliente que debe consumir la central para proporcionar la potencia útil adecuada.
Un cilindro contiene 3 moles de helio ambiente suponer a 27 grados celsius. Hallar a) El calor que se debe transferir al gas para aumentar su temperatura hasta 500K si se calienta a volumen constante b)El calor que se debe transferir al gas a presión constante para aumentar su temperatura hasta 500k c) El trabajo realizado por el gas.
1.En un proceso isocórico la variación de volumen es nula por lo tanto no hay trabajo
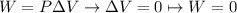
Por el primer principio de la termodinámica tenemos
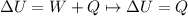
en esas condiciones el calor necesario para elevar la temperatura a 500°K será
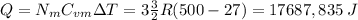
2.el calor necesario para elevar la temperatura a 500°K a presióon constante será
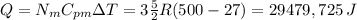
3.el trabajo será
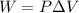
el volumen de gas lo obtenemos de la ecuacion de los gases ideales 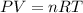
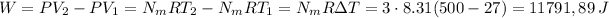
Tenemos 2 recipientes llenos de gas conectados con una válvula cerrada. El 1er recipiente tiene un gas con una presión de 175000 pascales, un volumen de 12,8 litros y una temperatura de 320K. El 2do recipiente tiene una presión de 220000 pascales, un volumen 22,4 litros y una temperatura de 450°K: Se abre la válvula y se mezclan, quedando uniformes la presión y la temperatura.
1.¿Cuál será la Presión final?
2.¿Cuál será la Temperatura final?
Masa molecular del gas = 32gr/mol Calor específico del gas = 12,5 J/Kg.K Constante de los gases ideales = 8,314 J/mol.K


